Par M. Genet
Les modèles biomécaniques sont considérés comme de bons candidats pour améliorer le diagnostic et le traitement des patients de diverses maladies, affectant notamment la mécanique vasculaire, cardiaque ou respiratoire.
Pour ce faire, ces modèles doivent d'abord être formulés avec des lois de comportement et des paramètres génériques qui sont développés parallèlement à des expériences. Et une fois ces modèles génériques mis en place, les données cliniques doivent être assimilées pour les personnaliser et donc produire un diagnostic et/ou effectuer une optimisation in silico du traitement. Aujourd'hui, la plupart des pipelines de modélisation personnalisés se concentrent sur l'état actuel du tissu/de l'organe, et peu de travaux portent sur la prévision de l'évolution à long terme du système d'intérêt, c'est-à-dire le pronostic. De même, des modèles constitutifs de la réponse mécanique des tissus mous ont été établis et sont largement acceptés dans la communauté, mais les modèles de remodelage des tissus mous sont plus controversés. Cela s'explique par la complexité accrue et la diminution de la compréhension associée des mécanismes physiques en jeu lors du remodelage. Spécifiquement pour la croissance, un mécanisme de remodelage associé à l'addition et/ou l'élimination de matière aux propriétés inchangées, il existe des approches concurrentes pour la description même de la croissance (décomposition multiplicative du gradient de la transformation vs. théorie des mélanges contraints), la force motrice de la croissance (chimique vs. mécanique, déformation vs. contrainte, chargement statique vs. oscillatoire, etc.). Néanmoins, la prochaine génération d'outils cliniques personnalisés basés sur la modélisation pour le pronostic et l'optimisation du traitement pourrait inclure des mécanismes de remodelage tels que la croissance. Par exemple, des modèles de croissance tumorale pourraient être utilisés pour évaluer la criticité des tumeurs cérébrales, et des modèles de croissance du myocarde pourraient être utilisés pour optimiser la forme des anneaux d'annuloplastie.
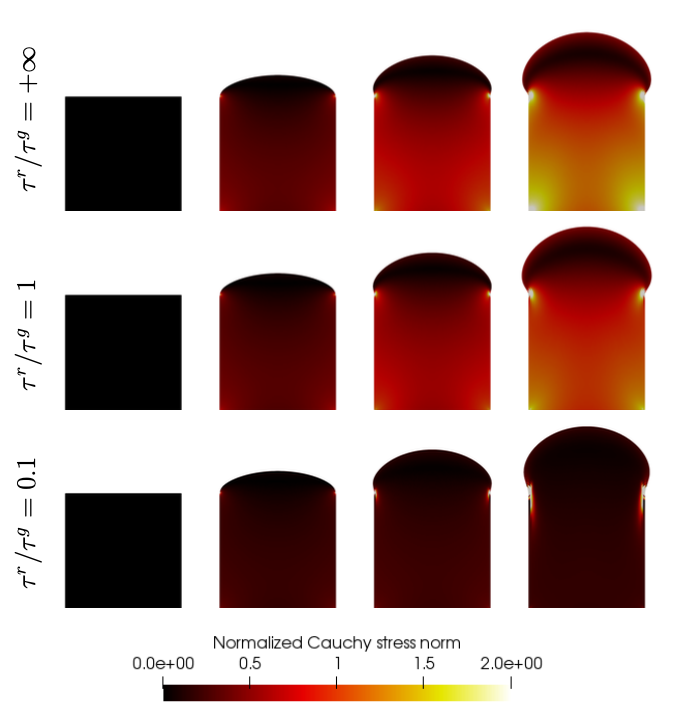 Une question importante associée à la modélisation de la croissance concerne les contraintes résiduelles induites, ou de manière équivalente, la prédéformation. D'une part ils sont présents dans les tissus vivants, d'autre part la croissance induit naturellement des contraintes résiduelles; cependant la question de savoir quelle part des contraintes résiduelles induites par la croissance physiologique ou pathologique reste au sein du tissu, et quelle part est relâchée par un mécanisme de relaxation, reste largement débattue. En fait, il a été constaté expérimentalement, dans des études impliquant une croissance pathologique induite par l'hypertension des tissus cardiovasculaires, que l'angle d'ouverture, et donc les contraintes résiduelles, n'étaient que très peu corrélés à la croissance. En conséquence, dans les modèles de croissance de la littérature, certains auteurs ont choisi de conserver les contraintes résiduelles induites par la croissance, et d'autres ont choisi de les supprimer.
Une question importante associée à la modélisation de la croissance concerne les contraintes résiduelles induites, ou de manière équivalente, la prédéformation. D'une part ils sont présents dans les tissus vivants, d'autre part la croissance induit naturellement des contraintes résiduelles; cependant la question de savoir quelle part des contraintes résiduelles induites par la croissance physiologique ou pathologique reste au sein du tissu, et quelle part est relâchée par un mécanisme de relaxation, reste largement débattue. En fait, il a été constaté expérimentalement, dans des études impliquant une croissance pathologique induite par l'hypertension des tissus cardiovasculaires, que l'angle d'ouverture, et donc les contraintes résiduelles, n'étaient que très peu corrélés à la croissance. En conséquence, dans les modèles de croissance de la littérature, certains auteurs ont choisi de conserver les contraintes résiduelles induites par la croissance, et d'autres ont choisi de les supprimer.
Dans ce travail, nous avons introduit un nouveau modèle de ``croissance relaxée'', dans le cadre général de la décomposition multiplicative du gradient de la transformation, qui permet de contrôler la quantité de contraintes résiduelles induites par la croissance. L'idée générale est d'ajouter une autre sous-transformation dans la décomposition, qui détend le tissu en transformant sa configuration déchargée. Le modèle est très général et pourrait être appliqué à tous les tissus mous, y compris les artères, le myocarde, la peau, le cerveau, etc. Des illustrations sont fournies dans l'article sur la croissance pilotée par le temps ainsi que le problème de croissance pilotée par la tension de l'artère sous pression interne.
Publication
Genet, M., 2019. A relaxed growth modeling framework for controlling growth-induced residual stresses. Clinical Biomechanics 70, 270–277. https://doi.org/10.1016/j.clinbiomech.2019.08.015
 Martin Genet est actuellement Assistant Professeur au Département de Mécanique et chercheur au Laboratoire de Mécanique des Solides, au sein de l'équipe M3DISIM. Il a effectué sa thèse au Laboratoire de Mécanique et de Technologie de Cachan et un post-doctorat au Lawrence Berkeley National Laboratory en Californie.Grace a une bourse Marie Curie de la Commission Européenne, il a passé trois années entre l'Université de Californie à San Francisco, l'Université de Stanford et l'École Polytechnique Fédérale de Zurich.
Martin Genet est actuellement Assistant Professeur au Département de Mécanique et chercheur au Laboratoire de Mécanique des Solides, au sein de l'équipe M3DISIM. Il a effectué sa thèse au Laboratoire de Mécanique et de Technologie de Cachan et un post-doctorat au Lawrence Berkeley National Laboratory en Californie.Grace a une bourse Marie Curie de la Commission Européenne, il a passé trois années entre l'Université de Californie à San Francisco, l'Université de Stanford et l'École Polytechnique Fédérale de Zurich.
Ses travaux actuels concernent l'ingénierie biomédicale des tissus mous, notamment la modélisation de la croissance des tissus, le traitement d'images biomédicales, avec des applications en cardiologie mais aussi plus récemment en pneumologie.Pour son travail, il a reçu en 2018 le Prix du Jeune Chercheur de la Société Francophone de Biomécanique, et en 2019 une ANR Jeune Chercheur autour de la modélisation du poumon.
© 2020 par l’auteur. Sauf mention contraire, le contenu du blog de la Société de Biomécanique (texte et figures) est distribué sous licence Creative Commons Attribution - Partage dans les mêmes conditions 4.0.



